-

-
中基醫學親子鑒定谘詢中心
-
中基醫學親子鑒定中心在國內大部分城市均開設親子鑒定采樣點,持證醫護上門采樣,公司依托高科技企業的雄厚
-
-

-
親子鑒定谘詢中心
-
世華雲檢是一家專注於鑒定領域技術谘詢服務的正規親子鑒定谘詢中心,專注於普通親權以及複雜的親緣關係鑒定
-
-

-
親子鑒定谘詢中心
-
世華雲檢親子鑒定谘詢中心專注於親子鑒定谘詢服務。實驗室憑借先進的技術設備和專業的檢測團隊,提供包括D
-
-

-
世華雲檢親子鑒定中心
-
世華雲檢是一家專注於DNA檢測與基因檢測的高科技服務機構,致力於為個人、家庭及機構提供精準、可靠的基
-
-

-
天津阿波羅醫院
-
天津阿波羅醫院特色診療:陽痿早泄、性功能障礙、包皮包莖、前列腺疾病、生殖感染、男性不育。以“中西醫結
-
-

-
成都曙光醫院
-
成都曙光醫院,始於2004年。經衛生主管部門批準設立,是一所集科研、醫療、保健為一體專注於男性健康領
-
-
-
北京勁鬆中西醫結合醫院
-
北京勁鬆中西醫結合醫院坐落於北京市朝陽區南新園中路112號,地處勁鬆商圈附近、華威橋東,地理位置優越
-
-

-
杭州附一皮膚病醫院
-
杭州附一皮膚性病醫院成立於2015年,位於杭州市拱墅區莫幹山路759號,是一所經杭州市衛計委批準的二
-
-

-
昆明曙光醫院
-
昆明曙光醫院位於昆明市西山區安康路195號,擁有眾多臨床經驗豐富、醫德良好的醫生團隊坐診,診療設備齊
-
-

-
忠證檢測
-
忠證檢測親子鑒定中心是一家專注於DNA親子鑒定的專業谘詢機構。擁有先進的實驗室與技術團隊,提供隱私親
-
-

-
杭州阿波羅醫院
-
杭州阿波羅醫院是男科品牌專業醫院,由杭州市拱墅區衛生局批準成立,醫院以“患者與服務對象至上”為核心價
-
-

-
杭州附一皮膚病醫院
-
杭州附一皮膚病醫院是一家專注皮膚健康領域,集科研、醫療、預防、康複於一體的現代化皮膚病專科醫院。醫院
-
-

-
杭州甲康醫院
-
杭州甲康醫院是經杭州市批準的一家具有專科特色的現代化綜合性醫院,省市醫保定點單位(住院醫保+門診醫保
-
-

-
中檢國權親子鑒定中心
-
中檢國權基因親子鑒定中心(簡稱“國權基因”)是一家經正規認證的基因檢測谘詢服務機構,成立於2019年
-
-
-
成都風濕醫院
-
-
-

-
鄭州痛風風濕病醫院
-
鄭州痛風風濕病醫院位於鄭州市二七區大學南路96號(地鐵七號線王胡砦站B口出,往北直行100米左右)
-
-

-
永泰助孕
-
服務人群有:試管反複失敗、高齡大齡、不孕不育群體、精卵異常等等。讓試管求子患者花更少的錢、更省的時間
-
-

-
康泰國際幹細胞
-
北京亦莊自貿區高端產業片區生物醫藥園北京康泰聯和國際生物科技有限公司,集團公司與美國科學院院士、20
-
-

-
廣州科大中醫醫院
-
-
-

-
廈門亞當醫院
-
本院是一所集醫療、科研、預防、康複於一體的現代化專業男科醫療機構。我們秉承“患者至上、專業專注、誠信
-
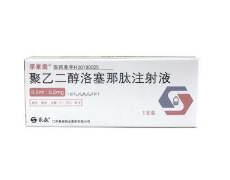
孚來美(聚乙二醇洛塞那肽注射液)
通用名稱:孚來美(聚乙二醇洛塞那肽注射液)
批準文號:國藥準字H20190025
生產企業: 江蘇豪森藥業集團有限公司
功能主治:本品配合飲食控製和運動,單藥或與二甲雙胍聯合,用於改善成人2型糖尿病患者的血糖控製
溫馨提示:外觀包裝僅供參考;請按藥品說明書或者在藥師指導下購買和使用。
| 藥品信息 | |||
| 主要成分 |
本品主要成份為聚乙二醇洛塞那肽 化學名稱:組氨酰-D-丙氨酰-穀氨酰-甘氨酰-蘇氨酰-苯丙氨酰-蘇氨酰-絲氨酰-門冬氨酰-亮氨酰-絲氨酰-賴氨酰-穀氨酰氨酰-正亮氨酰-穀氨酰-穀氨酰-穀氨酰-丙氨酰-纈氨酰-精氨酰-亮氨酰-苯丙氨酰-異亮氨酰-穀氨酰-色氨酰-亮氨酰-賴氨酰-穀氨酰氨酰-甘氨酰-甘氨酰-脯氨酰-絲氨酰-絲氨酰-甘氨酰-丙氨酰-脯氨酰-脯氨酰-脯氨酰-硫-((3RS)-1-3-((2-(Na.Na-二)w-甲氧基聚(氧乙烯基)羰基)賴氨酰氨)-乙基)氨基)-3-氧丙基)-2.5-二氧吡咯烷-3-基)半胱氨酰氨。 分子式:C210H325N55O69S●(C2H4O)2n 分子量:44212.65±4000Da 輔料:醋酸鈉、醋酸、甘露醇和注射用水。 |
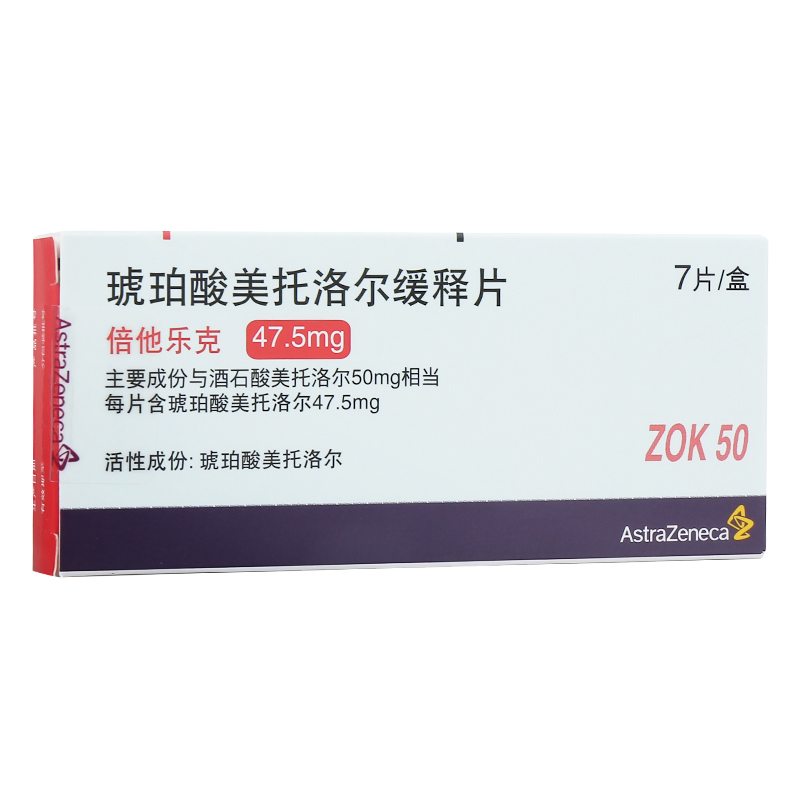
本品主要成份為琥珀酸美托洛爾。 |
|
| 生產企業 |
江蘇豪森藥業集團有限公司 |
阿斯利康製藥有限公司 |
|
| 批準文號 |
國藥準字H20190025 |
國藥準字J20150044 |
|
| 說明 | |||
| 作用與功效 |
本品配合飲食控製和運動,單藥或與二甲雙胍聯合,用於改善成人2型糖尿病患者的血糖控製 |
高血壓。心絞痛。伴有左心室收縮功能異常的症狀穩定的慢性心力衰竭。 |
|
| 用法用量 |
單藥治療:對於飲食控製和運動基礎上血糖控製不佳的患者,.本品推薦起始劑量為0.1mg,每周(7天)一次腹部皮下注射,如血糖控製效果不滿意,可增加到0.2mg,每周一次。 聯合治療:對於二甲雙胍基礎用藥血糖控製不佳的患者,本品推薦劑量為0.1mg.每周一次。 應每周(7天)給藥一次,可以在一天中任何時間(進餐前或進餐後)使用。忘記注射時,如果與下次計劃注射時間超過3天,可以立即給予補充注射:如果與下次計劃注射時間少於或等於3天,則無需補充注射。兩針之間應至少間隔3天。改變給藥計劃後應重新調整注射時間表。 不能靜脈或肌肉注射。建議經常變換腹部注射部位,避免長期注射腹部同一-部位。 每次注射前應檢查藥品,如注射液出現顆粒或溶液出現渾濁不透明,切勿使用。 針對預灌封注射器的使用說明:注射時,一手拇指和食指輕輕將注射部位的皮膚及皮下脂肪輕輕提起,另一手持注射器,針頭斜麵向上,與皮膚保持30~40°傾斜角度或垂直快速刺人皮下(低體重患者建議30-40°角進針)。進針嚐試根據皮下脂肪厚度,通常針頭刺入深度為0.5~1.0cm,回抽無回血後注入藥液。 針對筆式注射器的使用說明:市售的胰島索注射筆不適用於本品,本品需裝配於配套的筆式注射器中使用,使用方法及注意事項詳見後附的配套筆式注射器使用說明書。 特殊人群用藥說明: 腎功能不全患者:輕度腎功能不全患者無需調整劑量,中度腎功能不全患者如需使用應降低劑量。本品未在重度腎功能不全患者中開展研究, 尚無肝功能不全患者臨床數據。 老年人用藥劑景無需調整 不建議18歲以下患者使用本品。單藥治療:對於飲食控製和運動基礎上血糖控製不佳的患者,.本品推薦起始劑量為0.1mg,每周(7天)一次腹部皮下注射,如血糖控製效果不滿意,可增加到0.2mg,每周一次。 聯合治療:對於二甲雙胍基礎用藥血糖控製不佳的患者,本品推薦劑量為0.1mg.每周一次。 應每周(7天)給藥一次,可以在一天中任何時間(進餐前或進餐後)使用。忘記注射時,如果與下次計劃注射時間超過3天,可以立即給予補充注射:如果與下次計劃注射時間少於或等於3天,則無需補充注射。兩針之間應至少間隔3天。改變給藥計劃後應重新調整注射時間表。 不能靜脈或肌肉注射。建議經常變換腹部注射部位,避免長期注射腹部同一-部位。 每次注射前應檢查藥品,如注射液出現顆粒或溶液出現渾濁不透明,切勿使用。 針對預灌封注射器的使用說明:注射時,一手拇指和食指輕輕將注射部位的皮膚及皮下脂肪輕輕提起,另一手持注射器,針頭斜麵向上,與皮膚保持30~40°傾斜角度或垂直快速刺人皮下(低體重患者建議30-40°角進針)。進針嚐試根據皮下脂肪厚度,通常針頭刺入深度為0.5~1.0cm,回抽無回血後注入藥液。 針對筆式注射器的使用說明:市售的胰島索注射筆不適用於本品,本品需裝配於配套的筆式注射器中使用,使用方法及注意事項詳見後附的配套筆式注射器使用說明書。 特殊人群用藥說明: 腎功能不全患者:輕度腎功能不全患者無需調整劑量,中度腎功能不全患者如需使用應降低劑量。本品未在重度腎功能不全患者中開展研究, 尚無肝功能不全患者臨床數據。 老年人用藥劑景無需調整 不建議18歲以下患者使用本品。單藥治療:對於飲食控製和運動基礎上血糖控製不佳的患者,.本品推薦起始劑量為0.1mg,每周(7天)一次腹部皮下注射,如血糖控製效果不滿意,可增加到0.2mg,每周一次。 聯合治療:對於二甲雙胍基礎用藥血糖控製不佳的患者,本品推薦劑量為0.1mg.每周一次。 應每周(7天)給藥一次,可以在一天中任何時間(進餐前或進餐後)使用。忘記注射時,如果與下次計劃注射時間超過3天,可以立即給予補充注射:如果與下次計劃注射時間少於或等於3天,則無需補充注射。兩針之間應至少間隔3天。改變給藥計劃後應重新調整注射時間表。 不能靜脈或肌肉注射。建議經常變換腹部注射部位,避免長期注射腹部同一-部位。 每次注射前應檢查藥品,如注射液出現顆粒或溶液出現渾濁不透明,切勿使用。 針對預灌封注射器的使用說明:注射時,一手拇指和食指輕輕將注射部位的皮膚及皮下脂肪輕輕提起,另一手持注射器,針頭斜麵向上,與皮膚保持30~40°傾斜角度或垂直快速刺人皮下(低體重患者建議30-40°角進針)。進針嚐試根據皮下脂肪厚度,通常針頭刺入深度為0.5~1.0cm,回抽無回血後注入藥液。 針對筆式注射器的使用說明:市售的胰島索注射筆不適用於本品,本品需裝配於配套的筆式注射器中使用,使用方法及注意事項詳見後附的配套筆式注射器使用說明書。 特殊人群用藥說明: 腎功能不全患者:輕度腎功能不全患者無需調整劑量,中度腎功能不全患者如需使用應降低劑量。本品未在重度腎功能不全患者中開展研究, 尚無肝功能不全患者臨床數據。 老年人用藥劑景無需調整 不建議18歲以下患者使用本品。單藥治療:對於飲食控製和運動基礎上血糖控製不佳的患者,.本品推薦起始劑量為0.1mg,每周(7天)一次腹部皮下注射,如血糖控製效果不滿意,可增加到0.2mg,每周一次。 聯合治療:對於二甲雙胍基礎用藥血糖控製不佳的患者,本品推薦劑量為0.1mg.每周一次。 應每周(7天)給藥一次,可以在一天中任何時間(進餐前或進餐後)使用。忘記注射時,如果與下次計劃注射時間超過3天,可以立即給予補充注射:如果與下次計劃注射時間少於或等於3天,則無需補充注射。兩針之間應至少間隔3天。改變給藥計劃後應重新調整注射時間表。 不能靜脈或肌肉注射。建議經常變換腹部注射部位,避免長期注射腹部同一-部位。 每次注射前應檢查藥品,如注射液出現顆粒或溶液出現渾濁不透明,切勿使用。 針對預灌封注射器的使用說明:注射時,一手拇指和食指輕輕將注射部位的皮膚及皮下脂肪輕輕提起,另一手持注射器,針頭斜麵向上,與皮膚保持30~40°傾斜角度或垂直快速刺人皮下(低體重患者建議30-40°角進針)。進針嚐試根據皮下脂肪厚度,通常針頭刺入深度為0.5~1.0cm,回抽無回血後注入藥液。 針對筆式注射器的使用說明:市售的胰島索注射筆不適用於本品,本品需裝配於配套的筆式注射器中使用,使用方法及注意事項詳見後附的配套筆式注射器使用說明書。 特殊人群用藥說明: 腎功能不全患者:輕度腎功能不全患者無需調整劑量,中度腎功能不全患者如需使用應降低劑量。本品未在重度腎功能不全患者中開展研究, 尚無肝功能不全患者臨床數據。 老年人用藥劑景無需調整 不建議18歲以下患者使用本品。單藥治療:對於飲食控製和運動基礎上血糖控製不佳的患者,.本品推薦起始劑量為0.1mg,每周(7天)一次腹部皮下注射,如血糖控製效果不滿意,可增加到0.2mg,每周一次。 聯合治療:對於二甲雙胍基礎用藥血糖控製不佳的患者,本品推薦劑量為0.1mg.每周一次。 應每周(7天)給藥一次,可以在一天中任何時間(進餐前或進餐後)使用。忘記注射時,如果與下次計劃注射時間超過3天,可以立即給予補充注射:如果與下次計劃注射時間少於或等於3天,則無需補充注射。兩針之間應至少間隔3天。改變給藥計劃後應重新調整注射時間表。 不能靜脈或肌肉注射。建議經常變換腹部注射部位,避免長期注射腹部同一-部位。 每次注射前應檢查藥品,如注射液出現顆粒或溶液出現渾濁不透明,切勿使用。 針對預灌封注射器的使用說明:注射時,一手拇指和食指輕輕將注射部位的皮膚及皮下脂肪輕輕提起,另一手持注射器,針頭斜麵向上,與皮膚保持30~40°傾斜角度或垂直快速刺人皮下(低體重患者建議30-40°角進針)。進針嚐試根據皮下脂肪厚度,通常針頭刺入深度為0.5~1.0cm,回抽無回血後注入藥液。 針對筆式注射器的使用說明:市售的胰島索注射筆不適用於本品,本品需裝配於配套的筆式注射器中使用,使用方法及注意事項詳見後附的配套筆式注射器使用說明書。 特殊人群用藥說明: 腎功能不全患者:輕度腎功能不全患者無需調整劑量,中度腎功能不全患者如需使用應降低劑量。本品未在重度腎功能不全患者中開展研究, 尚無肝功能不全患者臨床數據。 老年人用藥劑景無需調整 不建議18歲以下患者使用本品。單藥治療:對於飲食控製和運動基礎上血糖控製不佳的患者,.本品推薦起始劑量為0.1mg,每周(7天)一次腹部皮下注射,如血糖控製效果不滿意,可增加到0.2mg,每周一次。 聯合治療:對於二甲雙胍基礎用藥血糖控製不佳的患者,本品推薦劑量為0.1mg.每周一次。 應每周(7天)給藥一次,可以在一天中任何時間(進餐前或進餐後)使用。忘記注射時,如果與下次計劃注射時間超過3天,可以立即給予補充注射:如果與下次計劃注射時間少於或等於3天,則無需補充注射。兩針之間應至少間隔3天。改變給藥計劃後應重新調整注射時間表。 不能靜脈或肌肉注射。建議經常變換腹部注射部位,避免長期注射腹部同一-部位。 每次注射前應檢查藥品,如注射液出現顆粒或溶液出現渾濁不透明,切勿使用。 針對預灌封注射器的使用說明:注射時,一手拇指和食指輕輕將注射部位的皮膚及皮下脂肪輕輕提起,另一手持注射器,針頭斜麵向上,與皮膚保持30~40°傾斜角度或垂直快速刺人皮下(低體重患者建議30-40°角進針)。進針嚐試根據皮下脂肪厚度,通常針頭刺入深度為0.5~1.0cm,回抽無回血後注入藥液。 針對筆式注射器的使用說明:市售的胰島索注射筆不適用於本品,本品需裝配於配套的筆式注射器中使用,使用方法及注意事項詳見後附的配套筆式注射器使用說明書。 特殊人群用藥說明: 腎功能不全患者:輕度腎功能不全患者無需調整劑量,中度腎功能不全患者如需使用應降低劑量。本品未在重度腎功能不全患者中開展研究, 尚無肝功能不全患者臨床數據。 老年人用藥劑景無需調整 不建議18歲以下患者使用本品。 |
口服,一天一次,最好在早晨服用,可掰開服用,但不能咀嚼或壓碎,服用時應該用至少半杯液體送服。同時攝入食物不影響其生物利用度。劑量應個體化,以避免心動過緩的發生。下列是有效的用藥指導:高血壓:47.5-95mg,一日一次。服用95無效的患者可合用其它抗高血壓藥,最好是利尿劑和二氫吡啶類的鈣拮抗劑,或者增加劑量。心絞痛:95-190mg,一日一次。需要時可合用硝酸酯類藥物或增加劑量。在症狀穩定的心力衰竭中,與血管緊張素轉化酶抑製劑、利尿劑、也許還有洋地黃類藥物聯合治療。患者患有穩定性慢性心力衰竭,至少在最近6周未發生過急性心力衰竭,且至少在近2周未改變基本的治療。用β受體阻滯劑治療心力衰竭有時會引起暫時的症狀惡化。在某些病例,可以繼續治療或減少用量,而在另一些病例,可能需要停止治療。對於嚴重心力衰(NYHAIV)患者,隻能由那些對心力衰竭治療特別訓練有素的醫生決定是否開始用琥珀酸美托洛爾緩釋片治療。心功能II級的穩定性心力衰竭患者的用量治療起始的二周內,推薦的起始用量為23.75mg,一日一次。二周後,劑量可增至47.5mg,一日一次。此後,每二周劑量可加倍。長期治療的目標用量為190mg |
|
| 副作用 |
禁用於甲狀腺髓樣癌、甲狀腺髓樣癌家族史或有多發性內分泌腫瘤綜合征2型(MEN-2)的患者。 對聚乙醇洛塞那肽或本品中任何組份既往有嚴重過敏反應的患者禁用。 |
不良反應的發生率約為10%,通常與劑量有關。(詳見說明書表格)。偶有關節痛、肝炎、肌肉疼痛性痙攣、口幹、結膜炎樣症狀、鼻炎和注意力損害以及在伴有血管疾病的患者中出現壞疽的病例報道。 |
|
| 禁忌 |
|
孕婦及哺乳期婦女用藥:1.妊娠:β受體阻滯劑可引起胎兒或新生兒的心動過緩。因此在妊娠最後3個月以及分娩前後,使用β受體阻滯劑時應考慮到上述危險性。2.哺乳期婦女:美托洛爾可進入乳汁,但在治療劑量下不大可能會危及嬰兒。兒童用藥:兒童使用本品的經驗有限。老年用藥:無需調整劑量。 |
|
| 藥理作用 |
聚乙二醇洛塞那肽的臨床研究總共進行了13個臨床試驗,總共約1200多人至少注射了1次(表D)。 表1本品在臨床試驗不同階段的用藥暴露程度 本品進行了單藥治療及與二甲雙胍聯合治療的兩個III期試驗,均包括了24周的核心治療期及28周的延伸治療期,總治療時間為52周。安全性結果均顯示本品主要的不良反應為胃腸道不良反應,這與胰高血糖素樣肽-1(GLP-1)受體激動劑的藥理作用機製有關。胃腸道不良反應主要為惡心。嘔吐、腹瀉等、但發生率均較低,而且多為一過性,嚴重程度多為輕中度,無重度不良反應。臨床試驗中,有低血糖事件發生,但是發生率較低。詳細的不良反應如下: ●胃腸道不良反應 1.單藥治療單藥治療24周後,安慰劑組、本品0.1mg和0.2mg組總體不良反應發生率分別為15.45%、13.49%、28.33%。0.2mg組不良反應發生率高於安慰劑組和0.1mg組,主要由於較高的胃腸道不良反應所致。常見的胃腸道不良反應包括惡心、嘔吐、腹瀉等。其中惡心和嘔吐的發生率與劑量成正相關,嚴重程度多是輕度或者中度,且多為一過性。單藥治療核心期各組發生率≥5%的不良反應詳情見表2: 表2單藥治療核心期各組發生率≥5%的不良反應(%) 注:N-例數 *按照本品0.2mg組發生率降療排序。 進入延伸期後“胃腸道係統不良反應發生率較核心期降低,未發生≥5%的不良反應。 2.二甲雙胍合並治療 聯合二甲雙胍核心期治療24周後,安慰劑組、本品0.1mg組和0.2mg組總體不良反應發生率分別為7.7%、10.4%、17.4%。和單藥治療試驗一樣,0.2mg治療組不良反應率與0.1mg組、安慰劑組比有升高趨勢、這主要是由較高的胃腸道不良反應所致。延伸期不良反應發生率較核心期明顯下降。核心期和延伸期均未發生≥5%的不良反應。 ●低血糖 單藥治療各組低血糖發生率均較低,核心期低血糖發生率見表3,無嚴重低血糖發生:進人延伸期後,各組低血糖發生率均<2%且無劑量相關性;無嚴重低血糖發生。 與二甲雙胍合用24周,低血糖發生率見表3。各組低血糖發生率均較低且未見劑量相關性,所有低血糖均為輕度。延伸期各組低血糖發生率均<2%且無劑量相關性:無嚴重低血糖發生, 表3本品單藥及與二甲雙胍合並治療核心期低血糖發生率 注N=例數 ●注射部位不良反應: 單藥治療試驗在0.2mg治療組有例受試者在核心期內出現6次注射部位反應,研究者判斷與研究藥物可能有關,嚴重程度為1級(輕度)。該受試者完成52周隨訪,在延伸期未出現注射部位不良反應。 與二甲雙聯合治療試驗0.2mg治療組一例受試者在延伸期出現1次注射部位出血.研究者判斷與研究藥物可能有關,嚴重程度為1級(輕度)。 ●免疫原性: 患者在接受本品治療後可能會產生抗藥抗體。單藥和二甲雙胍聯合治療試驗總共分析了來自977名受試者的血清樣本,51名受試者檢出陽性抗體、總抗體陽性率為5.2%,各治療組抗體發生率不超過6.73%。在24周時,抗體陽性的受試者0.1mg治療組(5例)HbAle下降0.5%、0.2mg治療組(4例)HbAlc升高0.13%,而抗體陰性的受試者在0.1mg治療組(264例)HbA1c下降1.0%、0.2mg冶療組(250例)HbAlc下降1.2%;在52周時,抗體陽性的35例受試者,平均HbAlc降低0.26%,抗體陰性的751例受試者,平均HbA1c降低0.97%n陽性抗體可能對療效產生一定的影響。 ●肝毒性 本品未對肝髒產生有害影響。兩個III期試驗核心期的肝功能相關不良事件總數為26人,占全體受試者2.9%。核心期肝功能異常不良事件發生率,安慰劑組為2.0%(6例),本品0.1mg治療組為3.2%(10例),本品0.2mg治療組為3.4%(10例),在0.2mg治療組除I例受試者因既往合並乙肝、酒精性肝硬化代償期而肝功能相關異常達到3級,研究者判斷可能無關,其他肝功能異常均為輕中度,大部分受試者轉歸為恢複治愈。延伸期不良事件和核心期相當。 ●脂類代謝 未發現本品對脂類代謝有影響。 ●其它 單藥及與二甲雙胍合並治療的兩個III期試驗中發生率≥1%的不良反應見下表。 表4在各組發生率1%的不良反應(%) 1.安慰劑本品0.1mg(N=53)表示核心期安慰劑組有53例在延伸期轉為使用本品0.1mg; 2.安慰劑本品0.2mg(N=56)表示核心期安慰劑組有56例在延伸期轉為使用本品0.2mg 3.安慰劑本品0.1mg甲雙胍(N=79)表示核心則安慰劑聯合二甲雙胍有79例在延伸用轉為使用本品0.1mg聯合二甲雙服; 4.安慰劑/本品0.2mg二甲雙胍(N=77)表示核心期安慰劑聯合二甲雙胍77例在延伸期轉為使用本品0.2mg聯合二甲雙胍。 |
||
| 注意事項 |
●甲狀腺髓樣癌(MTC):臨床前動物試驗中發現本品高劑量下可致大鼠甲狀腺C細胞腺瘤。雖然在本品臨床試驗中未發現與甲狀腺C細胞相關的不良反應,而且無充分證據表明本品會導致人體甲狀腺C細胞腫瘤的發生。包括MTC,但仍然建議有甲狀腺髓樣癌,甲狀腺隨樣癌家族史或有多發性內分泌腫瘤綜合征2型(MEN-2)的患者禁用本品。 ●急性胰腺炎:因GLP-1受體激動劑類藥物有少數急性胰腺炎不良事件報告。如果患者有明確的胰腺炎病史,不建議使用本品。如接受本品治療的患者出現劇烈的腹痛並伴有嘔吐時,應該懷疑有發生急性胰腺炎的可能,需立即停止使用本品,並同時進行確診檢查及適時的治療。本品在1200多例受試者中進行過臨床試驗,僅二甲雙胍合並治療試驗中報告I例急性胰腺炎嚴重不良事件,該受試者為0.2mg劑世組,在急性胰腺炎發作前有暴夥暴食的病史,因此判斷與研究藥物可能無關。 ●因本品主要不良反應為胃腸道不良反應,包括:惡心、嘔吐和腹瀉,因此不建議有嚴重胃腸道疾病患者使用本品。 ●對駕駛和機械操作能力的影響:尚未研究本品對駕駛和機械操作能力的影響,應告知患者在駕駛和操作機械時預防低血糖發生、 ●過敏反應:未在臨床研究中發現有過敏反應;如果在使用本品時出現過敏反應,應立即停止使用並給予醫學對症處理。 ●本品不得用於1型糖尿病患者或治療糖尿病酮症酸中毒。 ●建議在中度腎功能不全(肌酐清除率<60ml/min)患者使用本品時降低劑量,當中度腎功能不全患者在使用本品時,從0.1mg上升到0.2mg劑量時需慎重。因未在重度(肌酐清除率<30m/min)及終未期腎功能不全受試者中進行研究,因此不建議在上述患者中使用本品。 ●對2個III期試驗的受試者進行心腦血管不良事件彙總分析,結果顯示在核心期各組不良事件發生率未見明顯差異,安慰劑、本品0.1mg劑量組、0.2mg劑量組的不良事件發生率分別是2.6、1.0%和4.4%.不良反應發生率安慰劑組為0.3%(1例),本品治療組均未見心腦血管不良反應發生,延長用藥(最長為52周)亦未見相關不良事件發生率升高。 ●在臨床試驗中未發現本品對肝髒和脂質代謝的不良影響,而且CLP-1類降糖約物未見報道GLP-1對肝髒引起損害。另外,PEC-肽類物質主要由尿中排出,少最從膽汁和類中排出,導致肝功能異常也很少有報道。但本品尚無肝功能不全患者中研究數據,不建議肝功能異常患者使用。對於長期使用本品的患者應關注肝功能和脂質代謝的影響。 |
1.美托洛爾可能使外周血管循環障礙疾病的症狀如間歇性跛行加重。對嚴重的腎功能損害、伴代謝性酸中毒的各種急症,及合用洋地黃時,必須慎重。 2.患變異型(Prinzmetal氏)心絞痛的患者,在使用β受體阻滯劑後可能會由於α受體介導的冠狀血管收縮而導致心絞痛發作的頻度和程度加重。因此,非選擇性β-受體阻滯劑不能用於此類患者。選擇性β1受體阻滯劑在使用時也必須慎重。 3.對支氣管哮喘或其他慢性阻塞性肺病患者,應同時給予足夠的擴支氣管治療,β2受體激動劑的劑量可能需要增加。 4.美托洛爾的治療對糖代謝的影響或掩蓋低血糖的危險低於非選擇性β受體阻滯劑。 5.在罕見的情況下,原有的中度房室傳導異常加重(很可能導致房室阻滯)。 β受體阻滯劑的治療可能會妨礙對過敏反應的治療,常規劑量的腎上腺素治療並不總能得到預期的療效。嗜鉻細胞瘤患者若使用琥珀酸美托洛爾,應考慮合並使用α受體阻滯劑。 6.在嚴重的症狀穩定性心力衰竭(心功能NYHA IV)患者中,有關本品的有效性/安全性的臨床對照研究資料有限,因此,這類患者的治療隻能由經驗豐富且訓練有素的醫生來開始。 7.心力衰竭的臨床研究通常剔除了那些伴有急性心肌梗 |
|
藥品查詢
最新資訊
更多熱門藥品
更多-

枸櫞酸西地那非片
西地那非適用於治療勃起功能障礙。
-

鹽酸非索非那定片
1.季節性過敏性鼻炎適用於緩解成人和6歲及6歲以上年齡兒童的季節性過敏性鼻炎相關的症狀,如打噴嚏,流鼻涕,鼻、齶、喉部發癢、眼睛發癢、潮濕、發紅。 2.慢性特發性蕁麻疹適用於治療成人和6歲及6歲以上年齡兒童的慢性特發性蕁麻疹的皮膚症狀,能夠顯著減輕瘙癢和風團的數量。
-

感冒靈膠囊
解熱鎮痛。用於感冒引起的頭痛,發熱,鼻塞,流涕,咽痛。
-

連花清瘟顆粒
清瘟解毒,宣肺泄熱。用於治療流行性感冒屬熱毒襲肺證,症見:發熱或高熱惡寒,肌肉酸痛,鼻塞流涕,咳嗽,頭痛,咽幹咽痛,舌偏紅,苔黃或黃膩。
-

參苓白術膠囊
健脾,益氣。用於體倦乏力,食少便溏。
-

遠紅外消炎止痛貼
適用於促進局部血液循環、輔助消炎、消腫和止痛。適用於對頸椎病、肩周炎、骨質增生、腰椎間盤突出、關節炎、肌纖維炎、軟組織扭挫傷、急性腰肌勞損的輔助治療。適用於緩解腿部關節、肌肉疼痛及肱骨外上髁炎引起的關節滑膜炎所致之疼痛。
-

加味藿香正氣丸
解表化濕,理氣和中。本品用於外感風寒,內傷濕滯,頭痛昏重,胸膈痞悶,脘腹脹痛,嘔吐泄瀉。
-

依折麥布片
1.原發性高膽固醇血症本品作為飲食控製以外的輔助治療,可單獨或與HMG-CoA還原酶抑製(他汀類)聯合應用於治療原發性(雜合子家族性或非家族性)高膽固醇血症,可降低總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、載脂蛋白B(ApoB)。 2.純合子家族性高膽固醇血症(HoFH)本品與他汀類聯合應用,可作為其他降脂治療的輔助療法(如LDL-C血漿分離置換法),或在其他降脂治療無效時用於降低HoFH患者的TC和LDL-C水平。 3.純合子穀甾醇血症(或植物甾醇血症)本品作為飲食控製以外的輔助治療,用於降低純合子家族性穀甾醇血症患者的穀甾醇和植物甾醇水平。
-

氯雷他定顆粒
用於治療季節性過敏性鼻炎(減輕鼻部或非鼻部症狀)及特發性蕁麻疹。
-

咳特靈膠囊
鎮咳,祛痰,平喘,消炎。用於咳喘及慢性支氣管炎咳嗽。
藥企推薦
更多-

廣東羅浮山國藥股份有限公司
廣東羅浮山國藥股份有限公司是一家從事藥品生產,藥品經營,中草藥收購等業務的公司,成立於2008年12月24日,公司坐落在廣東省,詳細地址為:惠州市博羅縣長寧鎮廣汕公路邊嶺排工業區(羅浮山藥業城);經國
-

北京韓美藥品有限公司
北京韓美藥品有限公司(以下簡稱北京韓美)成立於1996年3月,公司產品業務涉及兒科產品、消化科產品、骨科產品、抗感染藥等領域,98%的產品在國內成產,主要產品有媽咪愛、易坦靜、易安平、美常安、利動、
-

博福-益普生(天津)製藥有限公司
益普生集團作為一家有著八十多年製藥經驗的歐洲製藥集團,擁有20餘種上市產品及遍布全球近4000名的員工。公司的發展戰略是以三大治療領域內的高科技產品為基礎,即腫瘤、內分泌、神經肌肉類疾病,這些高
-

北京同仁堂股份有限公司同仁堂製藥廠
北京同仁堂股份有限公司同仁堂製藥廠成立於1990年11月21日,注冊地位於北京市大興區中關村科技園區大興生物醫藥產業基地天貴大街33號,法定代表人為張朝華。經營範圍包括加工、製造中成藥;出租辦公用房
-

輝瑞製藥有限公司
輝瑞在中國業務覆蓋全國300餘個城市,並在華上市了五大領域的高品質的創新藥物,包括腫瘤、疫苗、抗感染、炎症與免疫、罕見病等多個領域的處方藥和疫苗。多年來,輝瑞始終致力於“成為中國醫療衛生體係重要組成
-

石家莊以嶺藥業股份有限公司
石家莊以嶺藥業股份有限公司於1992年6月16日創建,公司以“繼承創新、造福人類”為企業宗旨,以“科技健康明天”為企業發展目標,以健康人類為己任,造福社會為弘願,始終堅持市場龍頭、科技驅動的創新發展
-

北京同仁堂科技發展股份有限公司製藥廠
北京同仁堂科技發展股份有限公司製藥廠成立於1980年07月31日,注冊地位於北京市豐台區南三環中路20號,法定代表人為王煜煒。經營範圍包括製造膠劑、口服液、丸劑、顆粒劑、糖漿劑、擦劑、氣霧劑、軟膠囊
-

海南碧凱藥業有限公司
海南碧凱藥業有限公司成立於1993年。是【國家高新技術企業】、國家工商總局【守合同重信譽單位】、海口工業【十佳企業】。擁有各類人才,員工近2000人。生產基地位於海口藥穀,占地134畝,建築麵積10