-

-
北京協和醫院
-
三級甲等
北京協和醫院是集醫療、教學、科研於一體的現代化綜合三級甲等醫院,是國家衛生健康委指定的全國疑難重症診治指導中心,最早承擔高幹保健和外賓醫療任務的醫院之一,也是高等醫學教育和住院醫師規範化培訓國家 級
-
-

-
四川大學華西醫院
-
三級甲等
錦江春色來天地,玉壘浮雲變古今。在中國曆史文化名城成都市錦江萬裏橋頭的華西壩,有一座聞名遐邇的醫學城,她就是四川大學華西臨床醫學院/華西醫院。追溯曆史,華西醫院起源於美國、加拿大、英國等國基督教會1
-
-

-
中國人民解放軍總醫院
-
三級甲等
一、曆史沿革中國人民解放軍總醫院前身是中國協和醫學院第二臨床學院,1953年10月,總後方勤務部衛生部決定將“中國協和醫學院第二臨床學院”改為“軍委直屬機關醫院”。1954年7月,總後方勤務部
-
-

-
複旦大學附屬中山醫院
-
三級甲等
複旦大學附屬中山醫院是國家衛生健康委員會委屬事業單位,是複旦大學附屬綜合性教學醫院。醫院開業於1937年,是中國人創建和管理的最早的大型綜合性醫院之一,隸屬於國立上海醫學院,為紀念中國民主革命的先驅孫
-
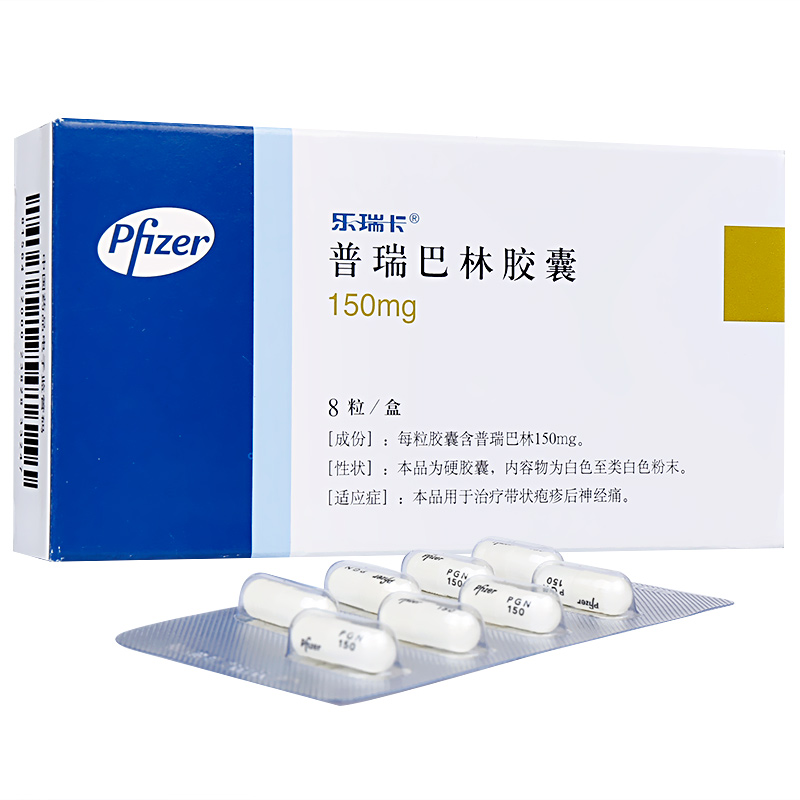
普瑞巴林膠囊
通用名稱:普瑞巴林膠囊
批準文號:國藥準字J20160022
生產企業: 輝瑞製藥有限公司
功能主治:1.廣泛性焦慮障礙; 2.糖尿病性外周神經病; 3.皰疹後神經痛; 4.纖維肌痛綜合征; 5.癲癇的輔助治療。
溫馨提示:外觀包裝僅供參考;請按藥品說明書或者在藥師指導下購買和使用。
| 藥品信息 | |||
| 主要成分 |
化學名稱:(3S)-3-(氨甲基)-5-甲基己酸 分子式:C8H17NO2 分子量:159.23 |
石菖蒲、雄雞、龍骨、遠誌、龜甲。 |
|
| 生產企業 |
輝瑞製藥有限公司 |
上海寶龍安慶藥業有限公司 |
|
| 批準文號 |
國藥準字J20160022 |
國藥準字Z34020580 |
|
| 說明 | |||
| 作用與功效 |
1.廣泛性焦慮障礙; 2.糖尿病性外周神經病; 3.皰疹後神經痛; 4.纖維肌痛綜合征; 5.癲癇的輔助治療。 |
開竅益智、調補心腎,滋養安神。用於心腎不足,痰濁阻竅所致的小兒多動,少語,煩躁不安,神思渙散,少寐健忘,潮熱盜汗;兒童多動症見上述症候者。 |
|
| 用法用量 |
本品可與食物同時服用,也可單獨服用。 本品推薦劑量為每次75或150mg,每日2... |
口服。一次10~15毫升,一日3次。 |
|
| 副作用 |
一項雙盲、安慰劑對照試驗發現,165名局部發作型癲癇病人在原有治療基礎上加上普瑞巴林治療(劑量為50、100、150、300和600mg/day,每日兩次)。最大劑量時大部分患者的耐受性良好。頭暈和嗜睡是最常出現的不良反應,600mg/day劑量組的發生率最高,頭暈發生率為42%,嗜睡的發生率為29%。而安慰劑組這兩種不良反應的發生率均為11%。大部分不良反應為輕到中度。8名患者因不良反應退出了試驗,這些患者均是300mg/day和600mg/day劑量組的患者。泛發型焦慮症和社交恐怖症患者所進行的臨床試驗也發現頭暈和嗜睡是最常出現的不良反應。 |
尚不明確。 |
|
| 禁忌 |
兒童用藥:由於該人群中安全性和療效的數據不充足,年齡小於12歲的兒童和青少年(12-17歲)不推薦使用樂瑞卡。 老年用藥:老年患者(年齡65歲以上)由於腎功能減退可能需要減量(見包裝內說明書) 孕婦及哺乳期婦女用藥:妊娠婦女使用普瑞巴林的數據不足。 動物研究顯示樂瑞卡具有生殖毒性。樂瑞卡對人類的可能風險目前未知。 除非必要(孕婦服藥的益處明顯大於藥物對胎兒的潛在風險),否則妊娠期間不應服用樂瑞卡。育齡婦女必須應用有效的避孕措施。 目前尚不清楚普瑞巴林是否經母乳分泌;但是,樂瑞卡可經大鼠的乳汁分泌。因此,不 |
|
|
| 成分 |
1.廣泛性焦慮障礙; 2.糖尿病性外周神經病; 3.皰疹後神經痛; 4.纖維肌痛綜合征; 5.癲癇的輔助治療。 |
開竅益智、調補心腎,滋養安神。用於心腎不足,痰濁阻竅所致的小兒多動,少語,煩躁不安,神思渙散,少寐健忘,潮熱盜汗;兒童多動症見上述症候者。 |
|
| 藥理作用 |
1.藥理作用 普瑞巴林與中樞神經係統中α2-δ位點(電壓門控鈣通道的一個輔助性亞基)有高度親和力。普瑞巴林的作用機製尚不明確,但是轉基因小鼠和結構相關化合物(例如加巴噴丁)的研究結果提示,在動物模型中的鎮痛及抗驚厥作用可能與普瑞巴林與α2-δ亞基的結合有關。體外研究顯示,普瑞巴林可能通過調節鈣通道功能而減少一些神經遞質的鈣依賴性釋放。 雖然普瑞巴林是抑製性神經遞質g-氨基丁酸(GABA)的結構衍生物,但它並不直接與GABAA, GABAB 或苯二氮卓類受體結合,不增加體外培養神經元的GABAA 反應,不改變大鼠腦中GABA濃度,對GABA攝取或降解無急性作用。但是研究發現,體外培養的神經元長時間暴露於普瑞巴林,GABA轉運蛋白密度和功能性GABA轉運速率增加。普瑞巴林不阻滯鈉通道,對阿 片類受體無活性,不改變環加氧酶活性,對多巴胺及5-羥色胺受體無活性,不抑製多巴胺、5-羥色胺或去甲腎上腺素的再攝取。 2.毒理研究 遺傳毒性:體外研究顯示普瑞巴林對細菌及哺乳動物細胞無致突變作用,體內及體外研究均顯示普瑞巴林不會導致哺乳動物染色體畸變,在大鼠或小鼠中不誘導肝細胞程序外DNA合成。 生殖 |
||
| 注意事項 |
),提示軀體依賴性。 15.自殺行為和想法 因任何適應症而接受抗癲癇藥(AED)治療的患者,抗癲癇藥(包括本品)會增加患者自殺想法或行為的風險。AED 治療期間,應監測患者是否出現下述症狀或症狀惡化:抑鬱、自殺想法或行為,和/或情緒或行為的任何異常變化。 對199 項包括11 種不同AED 的安慰劑對照臨床試驗(單藥治療和輔助治療)進行合並分析,發現AED 治療組患者的自殺想法或行為的風險約為安慰劑組患者的2 倍(調整後的相對風險為1.8,95% 可信區間:1.2, 2.7)。這些臨床試驗中位治療時間為12 周,27,863 例AED 治療組患者的自殺行為或想法發生率的估算值為0.43%,而16,029 例安慰劑組患者發生率的估算值為0.24%,表明每530 例治療患者中約增加1 例有自殺想法或行為的患者。試驗中藥物治療組有4 例自殺患者,安慰劑組無自殺患者;但因病例數太少,尚不能得出藥物對自殺影響的任何結論。 在AED 治療開始一周之後,即觀察到AED 治療可增加自殺想法或行為的風險,且持續存在於整個治療評估期間。因納入分析的大多數臨床試驗均不超過24 周,故未能評價24 周後自殺想 |
|
|
最新資訊
更多熱門藥品
更多藥企推薦
更多-

北京韓美藥品有限公司
北京韓美藥品有限公司(以下簡稱北京韓美)成立於1996年3月,公司產品業務涉及兒科產品、消化科產品、骨科產品、抗感染藥等領域,98%的產品在國內成產,主要產品有媽咪愛、易坦靜、易安平、美常安、利動、
-

博福-益普生(天津)製藥有限公司
益普生集團作為一家有著八十多年製藥經驗的歐洲製藥集團,擁有20餘種上市產品及遍布全球近4000名的員工。公司的發展戰略是以三大治療領域內的高科技產品為基礎,即腫瘤、內分泌、神經肌肉類疾病,這些高
-

北京同仁堂股份有限公司同仁堂製藥廠
北京同仁堂股份有限公司同仁堂製藥廠成立於1990年11月21日,注冊地位於北京市大興區中關村科技園區大興生物醫藥產業基地天貴大街33號,法定代表人為張朝華。經營範圍包括加工、製造中成藥;出租辦公用房
-

輝瑞製藥有限公司
輝瑞在中國業務覆蓋全國300餘個城市,並在華上市了五大領域的高品質的創新藥物,包括腫瘤、疫苗、抗感染、炎症與免疫、罕見病等多個領域的處方藥和疫苗。多年來,輝瑞始終致力於“成為中國醫療衛生體係重要組成
-

石家莊以嶺藥業股份有限公司
石家莊以嶺藥業股份有限公司於1992年6月16日創建,公司以“繼承創新、造福人類”為企業宗旨,以“科技健康明天”為企業發展目標,以健康人類為己任,造福社會為弘願,始終堅持市場龍頭、科技驅動的創新發展
-

北京同仁堂科技發展股份有限公司製藥廠
北京同仁堂科技發展股份有限公司製藥廠成立於1980年07月31日,注冊地位於北京市豐台區南三環中路20號,法定代表人為王煜煒。經營範圍包括製造膠劑、口服液、丸劑、顆粒劑、糖漿劑、擦劑、氣霧劑、軟膠囊